Đề kiểm tra học kì I môn Hóa học Lớp 11 CB - Trường THPT Krông Ana (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra học kì I môn Hóa học Lớp 11 CB - Trường THPT Krông Ana (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra học kì I môn Hóa học Lớp 11 CB - Trường THPT Krông Ana (Có đáp án)
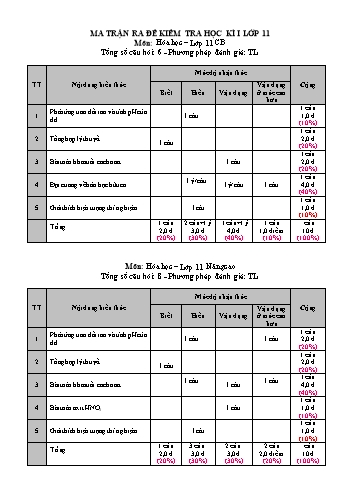
MA TRẬN RA ĐỀ KIỂM TRA HỌC KÌ I LỚP 11 Môn: Hóa học – Lớp 11 CB Tổng số câu hỏi: 6 - Phương pháp đánh giá: TL Mức độ nhận thức TT Nội dung kiến thức Vận dụng Cộng Biết Hiểu Vận dụng ở mức cao hơn 1 câu Phản ứng trao đổi ion và tính pH của 1 1 câu 1,0 đ dd (10%) 1 câu 2 Tổng hợp lý thuyết 2,0 đ 1 câu (20%) 1câu 3 Bài toán hh muối cacbonat 1 câu 2,0 đ (20%) 1 câu 1 ý/ câu 4 Đại cuơng về hóa học hữu cơ 1ý/ câu 1 câu 4,0 đ (40%) 1 câu 5 Giải thích hiện tuợng thí nghiệm 1câu 1,0 đ (10%) 1 câu 2 câu+1 ý 1 câu+1 ý 1 câu câu Tổng 2,0 đ 3,0 đ 4,0 đ 1,0 điểm 10 đ (20%) (30%) (40%) (10%) (100%) Môn: Hóa học – Lớp 11 Nâng cao Tổng số câu hỏi: 8 - Phương pháp đánh giá: TL Mức độ nhận thức TT Nội dung kiến thức Vận dụng Cộng Biết Hiểu Vận dụng ở mức cao hơn 1 câu Phản ứng trao đổi ion và tính pH của 1 1 câu 1 câu 2,0 đ dd (20%) 1 câu 2 Tổng hợp lý thuyết 2,0 đ 1 câu (20%) 1câu 1 câu 1 câu 3 Bài toán hh muối cacbonat 1 câu 4,0 đ (40%) 1 câu 4 Bài toán axit HNO3 1 câu 1,0 đ (10%) 1 câu 5 Giải thích hiện tuợng thí nghiệm 1câu 1,0 đ (10%) 1 câu 3 câu 2 câu 2 câu câu Tổng 2,0 đ 3,0 đ 3,0 đ 2,0 điểm 10 đ (20%) (30%) (30%) (20%) (100%) ................ ......... ........ ................ ......... ........ ................ ......... ........ ................ ......... ........ ................ ......... ........ ................ ......... ........ ................ ......... ........ ................ ......... ........ ................ ......... ........ ................ ......... ........ B. Chương trình nâng cao: + - Câu 5B. (1 điểm) ptđl HNO2 € H + NO2 . Ban đầu: 0,1M Điện li: x x x M C. bằng: 0,1-x x x M 0,25 điểm H NO 2 x.x 4 Hằng số cân bằng: Ka = 4.10 (Vì x quá nhỏ nên xem 0,1-x =0,1) 0,25 điểm HNO 2 0,1 x 4 -3 Vậy x = 0,1.4.10 = 6,325. 10 . = H 0,25 điểm -3 pH = -log H = -log(6,325.10 ) = 2,199 0,25 điểm Câu 6B. (1 điểm) + 2- Số mol H = số mol HCl = 0,1.1,6 = 0,16 mol; Số mol CO3 = số mol Na2CO3 = 0,2.0,6 = 0,12 mol 0,25 đ Do nhỏ từng giọt dd HCl vào dd Na2CO3 nên n nhỏ hơn nhiều n 2 do đó phản ứng xảy ra là: H CO3 2 H CO3 HCO3 0,12 0,12 mol 0,12 mol 0,25 điểm Số mol H+ còn lại sau phản ứng trên là: 0,16 – 0,12 = 0,04 mol 0,25 điểm - (< số mol HCO3 = 0,12 mol) H + HCO3 CO2 H2O 0,04 0,04 0,04 mol VCO2 = 0,04.22,4 = 0,896 lit 0,25 điểm Câu 7. (1 điểm) nCu = 6,4:64 =0,1 mol; n n 2n 0,12.1 2.0,12.0,5 0,24mol ; H HNO3 H2SO4 n nHNO 0,12.1 0,12 mol 0,5 điểm NO3 3 + - 2+ 3Cu + 8H + 2NO3 3Cu + 2NO + 4H2O 0,1 mol 0,24 mol 0,12 mol 0,1 0,24 0,12 2.0,24 nên số mol NO tính theo H+. n = 0,06 mol 0,25 điểm 3 8 2 NO 8 VNO = 0,06.22,4 = 1,344 lit 0,25 điểm Câu 8. (1 điểm) to X(HCO3)2 XO + 2CO2 + H2O. (X+122)g (X+16)g giảm 106g 24,3g 8,4g giảm 24,3-8,4=15,9g 0,5 điểm X 16 106 X = 40 (Ca) 0,25 điểm 8,4 15,9 Vậy công thức của muối là Ca(HCO3)2. 0,25 điểm (HS có thể giải cách khác)
File đính kèm:
 de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_11_cb_truong_thpt_krong.doc
de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_11_cb_truong_thpt_krong.doc

